Page 102 - 《广西植物》2024年第7期
P. 102
1 3 0 2 广 西 植 物 44 卷
愈伤组织样本进行单个测定ꎬ每个样品重复 3 次ꎬ 红山茶、尖萼红山茶、金蝶飞叶、南山茶、全缘红山
用于数据处理和分析ꎮ 茶、山手(表 1)ꎮ 其中ꎬ全缘红山茶的愈伤组织较为
松散ꎬ其他山茶种质培育的愈伤组织较为紧密且获
2 结果与分析 得的愈伤组织未出现明显的死亡与褐化等情况ꎬ说
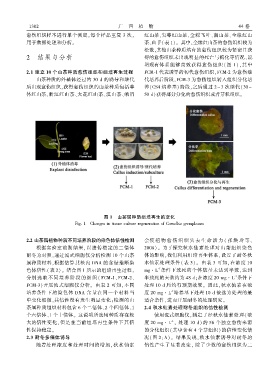
明现有体系能够高效获得愈伤组织( 图 1)ꎬ其中
2.1 建立 10 个山茶种质愈伤组织和组培再生过程 FCM ̄1 代表诱导的初代愈伤组织ꎬFCM ̄2 为愈伤继
山茶种质的外植体经过约 30 d 的诱导和继代 代培养后阶段ꎬFCM ̄3 为愈伤组织转入组织分化培
后出现愈伤组织ꎬ获得愈伤组织的山茶种质包括单 养(CS4 培养基) 阶段ꎬ之后通过 2 ~ 3 次继代(30 ~
体红山茶、浙江红山茶、大花红山茶、滇山茶、峨眉 50 d)获得部分分化的愈伤组织或者芽状组织ꎮ
图 1 山茶属种质组培再生的变化
Fig. 1 Changes in tissue culture regeneration of Camellia germplasms
2.2 山茶属植物种质不同培养阶段的染色体倍性检测 会使 植 物 愈 伤 组 织 失 去 生 命 活 力 ( 张 焕 玲 等ꎬ
根据实验室前期结果ꎬ以遗传稳定的二倍体 2008)ꎮ 为了探究秋水仙素处理对山茶组织染色
耐冬为对照ꎬ通过流式细胞仪分析检测 10 个山茶 体的影响ꎬ我们利用组培再生体系ꎬ设置了耐冬秋
属种质材料ꎬ根据估算其核内 DNA 的含量推断染 水仙素处理条件( 表 3)ꎮ 由表 3 可知ꎬ在浓度 10
 ̄1
色体倍性(表 2)ꎮ 结合图 1 所示的组培再生过程ꎬ mgL 条件下致死的个体数量未达到半数ꎬ达到
 ̄1
分别选取不同培养阶段 的 组 织 ( FCM ̄1、FCM ̄2、 半致死的天数约为 48 dꎻ在浓度 20 mgL 条件下
FCM ̄3)开展流式细胞仪分析ꎮ 由表 2 可知ꎬ不同 处理 10 d 后约有预期效果ꎮ 因此ꎬ秋水仙素在浓
培养条件下的染色体 DNA 含量在同一个材料当 度 20 mgL 培养基下处理 10 d 被选为处理的最
 ̄1
中变化细微ꎬ其倍性没有发生明显变化ꎻ检测的山 适合条件ꎬ进而开展耐冬的处理研究ꎮ
茶属种质组织材料包含 6 个二倍体、2 个四倍体、1 2.4 秋水仙素处理耐冬组织的倍性检测
个六倍体、1 个十倍体ꎮ 这说明所选用种质存在较 使用流式细胞仪ꎬ测定了经秋水仙素处理( 浓
大的倍性变化ꎬ但是在当前组培再生条件下其倍 度 20 mgL ꎬ 处理 10 d) 的 56 个独立愈伤来源
 ̄1
性保持稳定ꎮ 的分化组织(其中含有 4 个芽组织) 的倍性变化情
2.3 耐冬多倍体诱导 况(图 2:A)ꎮ 结果发现ꎬ秋水仙素诱导对耐冬的
随着处理浓度和处理时间的增加ꎬ秋水仙素 倍性产生了显著改变ꎬ 除了少数的愈伤组织为二