Page 103 - 《广西植物》2024年第7期
P. 103
7 期 李雅暄等: 不同山茶种质组培条件下染色体倍性的维持与变化 1 3 0 3
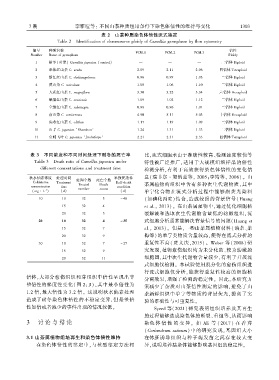
表 2 山茶种质染色体倍性流式鉴定
Table 2 Identification of chromosome ploidy of Camellia germplasm by flow cytometry
编号 种质名称 倍性
FCM ̄1 FCM ̄2 FCM ̄3
Number Name of germplasm Ploidy
1 耐冬(对照) Camellia japonica (control) — — — 二倍体 Diploid
2 单体红山茶 C. uraku 2.09 2.11 2.06 四倍体 Tetraploid
3 浙江红山茶 C. chekiangoleosa 0.96 0.99 1.03 二倍体 Diploid
4 滇山茶 C. reticulata 1.08 1.06 1.10 二倍体 Diploid
5 大花红山茶 C. magniflora 3.30 3.22 3.34 六倍体 Hexaploid
6 峨眉红山茶 C. omeiensis 1.09 1.02 1.12 二倍体 Diploid
7 全缘红山茶 C. subintegra 0.98 0.96 1.01 二倍体 Diploid
8 南山茶 C. semiserrata 4.90 5.11 5.03 十倍体 Decaploid
9 尖萼红山茶 C. edithae 1.17 1.19 1.09 二倍体 Diploid
10 山手 C. japonica ‘Shanshou’ 1.24 1.31 1.33 二倍体 Diploid
11 金蝶飞叶 C. japonica ‘Jindiefeiye’ 2.21 2.31 2.33 四倍体 Tetraploid
表 3 不同浓度和不同时间处理下耐冬的死亡率 比ꎬ流式细胞术由于准确性较高、检测速度较快等
Table 3 Death ratio of Camellia japonica under 特性被广泛推广ꎬ适用于大规模组织样品的倍性
different concentrations and treatment time 检测分析ꎬ有利于高效获得染色体倍性的变化信
秋水仙素浓度 处理时间 处理个数 死亡个数 半致死条件 息(瑞菲尔努纳兹等ꎬ 2005ꎻ李靖等ꎬ 2008)ꎮ 山
Colchicine Treatment Half ̄death
Treated Death 茶属植物的组织中含有多种次生代谢物质ꎬ其中
concentration time condition
 ̄1 number count
(mgL ) (d) (d) 单宁化合物在流式分析过程中能够跟荧光染料
10 10 32 3 ~ 48 (如碘化丙啶)结合ꎬ造成较强的背景信号( Huang
et al.ꎬ 2013)ꎮ 在山茶属植物中ꎬ通过优化细胞核
15 32 4
裂解液和选取次生代谢物含量低的幼嫩组织ꎬ流
20 32 3
20 10 32 4 ~ 35 式细胞分析通常能解决背景信号的问题(Huang et
al.ꎬ 2013)ꎮ 但是ꎬ一些山茶属植物材料( 油茶、茶
15 32 7
20 32 9 梅等)的单宁类物质含量较高ꎬ使得在流式分析的
重复性不高( 贾文庆ꎬ2015)ꎮ Weber 等(2008) 研
30 10 32 7 ~ 27
究发现ꎬ植物愈伤组织均为未分化的、较为幼嫩的
15 32 9
细胞团ꎬ其中次生代谢物含量较少ꎬ有利于开展流
20 32 11
式细胞仪检测ꎮ 本试验使用脱分化的愈伤组织进
行流式细胞仪分析ꎬ能获得重复性较高的细胞核
倍体ꎬ大部分愈伤组织和芽组织中倍性呈现出非
分离效果ꎬ增强了检测的稳定性ꎮ 因此ꎬ本研究方
整倍性的梯度性变化( 图 2:B)ꎬ其中最小倍性为 案减少了杂质对山茶倍性测定的影响ꎬ避免了山
1.2 倍ꎬ最大倍性为 3.2 倍ꎮ 这说明秋水仙素处理 茶新鲜组织中单宁等物质的背景荧光ꎬ提高了实
造成了耐冬染色体倍性的不稳定变异ꎬ但是整倍
验的准确性与可重复性ꎮ
性加倍或者减少的事件出现的情况较低ꎮ Syeed 等(2021)研究表明组织培养及其再生
的过程能够造成染色体的断裂、重组等ꎬ从而影响
3 讨论与结论 染色 体 倍 性 的 变 异ꎮ 如 Ali 等 ( 2017 ) 在 香 芹
(Coriandrum sativum) 中的研究发现ꎬ基因组大小
3.1 山茶属植物组培再生和染色体倍性维持 在体胚诱导组织与种子萌发苗之间存在较大变
在染色体倍性的鉴定中ꎬ与核型鉴定方法相 异ꎬ说明培养基条件能够影响基因组的稳定性ꎮ