Page 88 - 《广西植物》2023年第6期
P. 88
1 0 7 4 广 西 植 物 43 卷
 ̄1
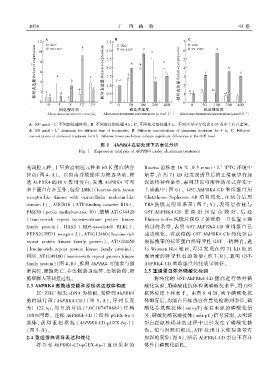
A. 100 μmolL 不同铝处理时间ꎻ B. 不同浓度铝处理 4 hꎻ C. 不同浓度铝处理 8 hꎮ 不同小写字母代表 0.05 水平上存在差异ꎮ
 ̄1
A. 100 μmol L aluminum for different time of treatmentsꎻ B. Different concentrations of aluminum treatment for 4 hꎻ C. Different
concentrations of aluminum treatment for 8 h. Different lowercase letters indicate significant differences at the 0.05 level.
图 1 AhPRK4 在铝处理下的表达分析
Fig. 1 Expression analysis of AhPRK4 under aluminum treatment
光调控元件ꎬ干旱胁迫响应元件和 60 K 蛋白结合 Rosetta 菌株在 16 ℃ 、0.5 mmolL IPTG 环境中
 ̄1
位点(图 4:A)ꎮ 以拟南芥数据库为筛选基础ꎬ筛 培养ꎬ在约 71 kD 处发现诱导后的上清液中有加
选 AhPRK4 的相互作用蛋白ꎬ发现 AhPRK4 可与 深的特异性条带ꎬ表明其以可溶性的形式存在于
多个蛋白存在互作ꎬ包括 LMK1( leucine ̄rich repeat 上清液中( 图 6) ꎮ GST ̄AhPRK4 ̄CD 重组蛋白用
receptor ̄like kinase with extracellular malectin ̄like Glutathione Sepharose 4B 填 料 纯 化ꎬ 在 结 合 后 用
domain 1)、 ABCB16 ( ATP ̄binding cassette B16)、 PBS 洗脱 无 明 显 条 带 ( 图 7:A) ꎬ 表 明 层 析 柱 与
PME30 (pectin methylesterase 30)、激酶 AT1G34420 GST ̄AhPRK4 ̄CD 重 组 蛋 白 结 合 较 好ꎬ 后 经
( leucine ̄rich repeat transmembrane protein kinase Elution buffer 洗脱后获得了条带单一且位置正确
family protein )、 HAK1 ( HDS ̄associated RLK1 )、 的目的条带ꎬ表明 GST ̄AhPRK4 ̄CD 重组蛋白 已
PEPR2( PEP1 receptor 2)、AT1G12460( leucine ̄rich 成功纯化ꎮ 将获得的 GST ̄AhPRK4 ̄CD 纯化蛋白
repeat protein kinase family protein )、 AT1G24650 根据携带的标签蛋白经特异性 GST 一抗孵育ꎬ进
(leucine ̄rich repeat protein kinase family protein)、 行 Western Blot 验证ꎬ可以发现在约 71 kD 处 出
FEI1、AT1G49100 ( leucine ̄rich repeat protein kinase 现清晰的特 异 性 目 的 条 带 ( 图 7:B) ꎬ表 明 GST ̄
family protein)(图 4:B)ꎬ推测 AhPRK4 可能参与激 AhPRK4 ̄CD 重组蛋白纯化效果较好ꎮ
素调控、细胞死亡、非生物胁迫应答、生物防御、细 2.5 重组蛋白体外磷酸化检测
胞壁膨大等调控过程ꎮ 将纯化的 GST ̄AhPRK4 ̄CD 蛋白进行体外磷
2.3 AhPRK4 激酶域克隆和原核表达载体构建 酸化实验ꎬ用磷酸化抗体检测磷酸化水平ꎬ用 GST
以‘ ZH2’ 根尖 cDNA 为模板ꎬ克隆到 AhPRK4 抗体标定上样水平ꎮ 由图 8 可知ꎬ两个磷酸化抗
胞内域 片 段 ( AhPRK4 ̄CD) ( 图 5: A) ꎬ 序 列 长 度 体孵育后ꎬ均能在目标蛋白位置处检测到条带ꎬ磷
为1 122 bpꎬ 与 目 的 片 段 ( LOC107470884) 序 列 酸化苏氨酸抗体( anti ̄pT) 有着更强的磷酸化信
100%同源ꎮ 连接 AhPRK4 ̄CD 片段和 pGEX ̄6p ̄1 号ꎬ磷酸化酪氨酸抗体(anti ̄pY) 信号较弱ꎬ表明该
载体ꎬ 获 得 重 组 质 粒 ( AhPRK4 ̄CD ̄pGEX ̄6p ̄1) 蛋白在原核诱导的过程中已经发生了磷酸化修
( 图 5:B) ꎮ 饰ꎮ 但与对照组相比ꎬATP 处理并未使得条带有
2.4 重组蛋白诱导表达和纯化 加深的现象(图 8)ꎬ暗示 AhPRK4 ̄CD 蛋白不存在
将 含 有 AhPRK4 ̄CD ̄pGEX ̄6p ̄1 重 组 质 粒 的 体外自磷酸化活性ꎮ