Page 129 - 《广西植物》2020年第8期
P. 129
1 1 8 4 广 西 植 物 40 卷
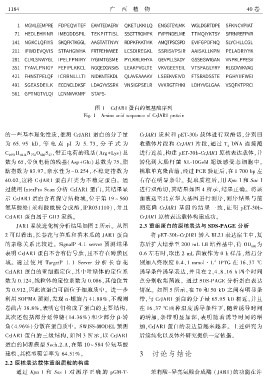
图 1 CrJAR1 蛋白的氨基酸序列
Fig. 1 Amino acid sequence of CrJAR1 protein
的一些基本理化性质ꎬ推测 CrJAR1 蛋白的分子量 CrJAR1 质粒和 pET ̄30b 载体进行双酶切ꎬ分别回
为 65. 95 kDꎬ 等 电 点 pI 为 5. 73ꎬ 分 子 式 为 收载体片段和 CrJAR1 片段ꎬ通过 T DNA 连接酶
4
C H N O S ꎬ带正电荷的残基( Arg+Lys) 总 进行连接ꎬ构建 pET ̄30b ̄CrJAR1 原核表达载体ꎬ并
2959 4614 772 880 27
数为 65ꎬ带负电荷的残基(Asp+Glu) 总数为 75ꎬ脂 转化到大肠杆菌 XL ̄10Gold 超级感受态细胞中ꎮ
肪指数为 83.97ꎬ亲水性为- 0.254ꎬ不稳定指数为 挑取单克隆菌落ꎬ经过 PCR 验证后ꎬ在 1 700 bp 左
40.02ꎬ这将 CrJAR1 蛋白归类为不稳定蛋白ꎮ 通 右存在明显条带ꎮ 提取质粒后ꎬ用 Kpn I 和 Sac I
过使用 InterPro Scan 分析 CrJAR1 蛋白ꎬ其结果显 进行双酶切ꎬ其结果如图 4 所示ꎬ结果正确ꎮ 将该
示 CrJAR1 蛋白含有保守结构域ꎬ位于第 19 ~ 560 菌液送至北京华大基因进行测序ꎬ测序结果与前
氨基酸处(茉莉酸酰胺合成酶ꎬIPR031110)ꎬ并且 期克 隆 CrJAR1 基 因 的 结 果 一 致ꎬ 证 明 pET ̄30b ̄
CrJAR1 蛋白属于 GH3 家族ꎮ CrJAR1 原核表达载体构建成功ꎮ
JAR1 系统进化树分析结果如图 2 所示ꎮ 从图 2.3 重组蛋白的原核表达与 SDS ̄PAGE 分析
2 可以看出ꎬ长春花与笋瓜和番木瓜的 JAR1 蛋白 将 pET ̄30b ̄CrJAR1 转入 BL21 表达宿主中ꎬ复
的亲缘关系比较近ꎮ SignalP 4.1 server 预测结果 苏后扩大培养至 200 mL LB 培养基中ꎬ待 OD 为
600
表明 CrJAR1 蛋白不含有信号肽ꎬ且不存在跨膜区 0.6 左右时ꎬ取出 2 mL 菌液作为 0 h 样品ꎬ然后分
域ꎮ 通 过 使 用 TargetP 1. 1 Server 分 析 长 春 花 别加入终浓度 0.4、1 mmolL IPTG 在 16、37 ℃
 ̄1
CrJAR1 蛋白的亚细胞定位ꎬ其中叶绿体的定位系 诱导条件诱导表达ꎬ并且在 2、4、8、16 h 四个时间
数为 0.124ꎬ线粒体的定位系数为 0.086ꎬ其他位置 点分别收集菌液ꎮ 通过 SDS ̄PAGE 分析蛋白表达
为 0.912ꎬ因此该蛋白可能位于细胞质中ꎮ 进一步 情况ꎮ 如图 5 所示ꎬ在 70 和 50 kD 之间有明显条
利用 SOPMA 预测ꎬ发现 α ̄螺旋占 41.88%ꎬ不规则 带ꎬ与 CrJAR1 蛋白的分子量 65.95 kD 相近ꎬ并且
卷曲占 38.8%ꎬ表明它们构成了蛋白的主要结构ꎬ 在 16、37 ℃ 两种温度诱导条件下ꎬ随着诱导时间
其次还包括部分延伸链(14.36%) 和少部分 β ̄转 的增加ꎬ条带明显加深ꎬ表明随着诱导时间的增
角(4.96%)分散在蛋白质中ꎮ SWISS ̄MODEL 预测 加ꎬCrJAR1 蛋白的表达量越来越多ꎮ 上述研究为
CrJAR1 蛋白的三级结构ꎬ如图 3 所示ꎬ以 CrJAR1 后续纯化以及体外研究提供一定依据ꎮ
蛋白的同源模型 5ech.2.Aꎬ在第 10 ~ 584 位氨基酸
建模ꎬ其模型覆盖率为 64.51%ꎮ 3 讨论与结论
2.2 原核表达载体重组质粒的构建
通过 Kpn I 和 Sac I 对 测 序 正 确 的 pGM ̄T ̄ 茉莉酸-异亮氨酸合成酶 (JAR1)的功能在许