Page 133 - 《广西植物》2024年第7期
P. 133
7 期 林立等: 代谢组与转录组联合解析赤皮青冈叶片黄化变异机制 1 3 3 3
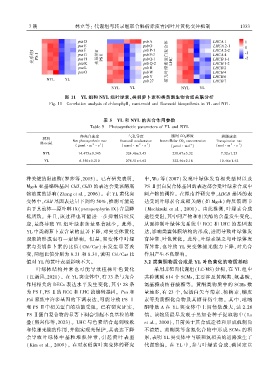
图 11 YL 组和 NYL 组叶绿素、类胡萝卜素和类黄酮生物合成关联分析
Fig. 11 Correlation analysis of chlorophyllꎬ carotenoid and flavonoid biosynthesis in YL and NYL
表 5 YL 和 NYL 的光合作用参数
Table 5 Photosynthetic parameters of YL and NYL
净光合速率 气孔导度 胞间 CO 2 浓度 蒸腾速率
材料
Net photosynthetic rate Stomatal conductance Intercellular CO 2 concentration Transpiration rate
Material
 ̄1
 ̄2
 ̄1
 ̄1
 ̄2
 ̄2
 ̄1
(μmolm s ) (mmolm s ) (μmolmol ) (molm s )
NYL 14.475±0.345 324.46±3.45 238.67±5.32 7.32±1.25
YL 6.350±0.210 278.51±4.62 322.46±2.18 10.46±1.42
种关键的限速酶(罗莎等ꎬ2015)ꎮ 已有研究表明ꎬ 中ꎬWu 等(2007) 发现叶绿体发育相关基因以及
Mgch 亚基编码基因 ChlI、ChlD 的表达会受该酶底 PS Ⅱ蛋白复合体基因的表达都会受叶绿素合成中
物浓度的影响(Zhang et al.ꎬ 2006)ꎮ 在 YL 黄化突 间产物的调控ꎮ 在拟南芥研究中ꎬLHCB 基因的表
变体中ꎬChlI 基因表达量下调约 50%ꎬ推测可能是 达受到叶绿素合成相关酶( 如 Mgch) 的反馈调节
由于其前体—原卟啉 IX(protoporphyrin IX)含量降 (Mochizuki et al.ꎬ 2001)ꎮ 由此推测ꎬ叶绿素合成
低所致ꎮ 并且ꎬ该过程也可能进一步抑制后续反 途径受阻ꎬ其中间产物和相关酶的含量发生变化ꎬ
应ꎬ最终导致 YL 组叶绿素含量显著减少ꎮ 此外ꎬ 从而抑制叶绿体光系统中 RCC 和 LHC 的基因表
YL 中类胡萝卜素含量的显著下降ꎬ对突变体黄化 达ꎬ影响类囊体膜结构的形成ꎬ进而导致叶绿体发
现象的形成也有一定影响ꎮ 但是ꎬ突变体中叶绿 育异常、叶色黄化ꎮ 此外ꎬ叶绿素缺乏与叶绿体发
素与类胡萝卜素的比值( Chl/ Car) 未发生显著改 育异常ꎬ也导致 YL 突变体捕光能力下降ꎬ对光合
变ꎬ两组比值分别为 8.21 和 8.31ꎬ说明 Chl/ Car 比 作用产生不良影响ꎮ
值对 YL 的黄叶表型影响不大ꎮ 3.2 类黄酮物质合成是 YL 叶色黄化的物质基础
叶绿体结构异常也可能 导 致 植 株 叶 色 黄 化 采用非靶向代谢组( LC ̄MS) 分析ꎬ在 YL 组中
(江新凤ꎬ2021)ꎮ 在 YL 突变体中ꎬ有 33 条与光合 共检测到 614 个 SCMsꎬ主要涉及黄酮类、氨基酸、
作用相关的 DEGs 表达水平发生变化ꎬ其中 28 条 氨基糖或核苷酸糖等ꎮ 黄酮类物质中的 SCMs 数
为 PS I、PS Ⅱ的 RCC 和 LHC 的编码基因ꎮ Psa 和 量最多ꎬ有 23 个ꎬ包括白矢车菊素、杨梅素、槲皮
Psb 家族中许多基因的下调表达ꎬ可能导致 PS Ⅰ 素等类黄酮化合物及其糖苷衍生物ꎮ 其中ꎬ吡喃
和 PS Ⅱ中相关蛋白的功能受阻ꎮ 已有研究证实ꎬ 酮啡肽 A 在 YL 突变体中上调倍数最大ꎬ达 2.28
PS Ⅱ蛋白复合物的显著下调会引起不良基粒的堆 倍ꎮ 该物质最早发现于黑加仑种子提取物中( Lu
叠(熊兴伟等ꎬ2023)ꎮ LHC 与色素结合起到吸收 et al.ꎬ 2000)ꎬ目前关于其合成途径和形成机制尚
和传递光能的作用ꎬ并能实现光保护ꎬ其表达下降 不清楚ꎮ 黄酮类等含氮化合物中形成 SCMs 的积
会导致 叶 绿 体 中 基 粒 堆 积 异 常ꎬ 引 起 黄 叶 表 型 累ꎬ表明 YL 突变体中与碳和氮相关的通路发生了
(Kim et al.ꎬ 2009)ꎮ 在对水稻黄叶突变体的研究 代谢重编ꎮ 在 YL 中ꎬ参与叶绿素合成、碳固定以