Page 132 - 《广西植物》2020年第6期
P. 132
8 7 8 广 西 植 物 40 卷
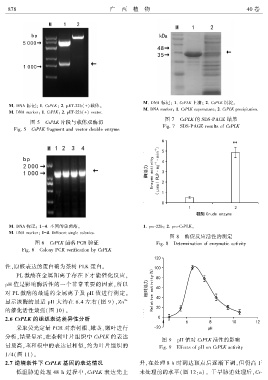
M. DNA 标记ꎻ 1. CsPLK 上清ꎻ 2. CsPLK 沉淀ꎮ
M. DNA 标记ꎻ 1. CsPLKꎻ 2. pET ̄22b( +)载体ꎮ
M. DNA markerꎻ 1. CsPLK supernatantꎻ 2. CsPLK precipitation.
M. DNA markerꎻ 1. CsPLKꎻ 2. pET ̄22b(+) vector.
图 7 CsPLK 的 SDS ̄PAGE 结果
图 5 CsPLK 片段与载体双酶切
Fig. 7 SDS ̄PAGE results of CsPLK
Fig. 5 CsPLK fragment and vector double enzyme
M. DNA 标记ꎻ 1-4. 不同的单菌落ꎮ 1. pro ̄22bꎻ 2. pro ̄CsPLKꎮ
M. DNA markerꎻ 1-4. Different single colonies.
图 8 酶促反应活性的测定
图 6 CsPLK 菌落 PCR 验证 Fig. 8 Determination of enzymatic activity
Fig. 6 Colony PCR verification by CsPLK
性ꎬ原核表达的蛋白确为茶树 PLK 蛋白ꎮ
PL 激酶在金属阳离子存在下才能催化反应ꎬ
pH 值是影响酶活性的一个非常重要的因素ꎬ所以
对 PL 激酶的最适的金属离子及 pH 值进行测定ꎮ
2+
显示该酶的最适 pH 大约在 6.4 左右( 图 9)ꎬZn
的催化活性最强(图 10)ꎮ
2.6 CsPLK 的组织表达差异性分析
采取荧光定量 PCR 对茶树根、嫩茎、嫩叶进行
分析ꎬ结果显示ꎬ在茶树叶片组织中 CsPLK 的表达
图 9 pH 值对 CsPLK 活性的影响
量最高ꎬ茎和根中的表达量相似ꎬ约为叶片组织的 Fig. 9 Effects of pH on CsPLK activity
1 / 4(图 11)ꎮ
2.7 逆境条件下 CsPLK 基因的表达情况 升ꎬ在处理 8 h 时到达顶点后逐渐下调ꎬ但仍高于
低温胁迫处理 48 h 过程中ꎬCsPLK 表达先上 未处理前的水平(图 12:a)ꎮ 干旱胁迫处理后ꎬCs ̄